この記事ではウイスキーづくりの花形「蒸溜」についての理解を深めることを目的にしています。
『何万回、何億回蒸溜してもエタノール100%の蒸溜液は手に入らない』
これがなぜなのか、すでに説明できる人はこの記事は読まなくて大丈夫です(笑)
「なぜ100%が不可能なのか気になる」
「多少知識はあるけど再確認したい」
「そもそも蒸溜がよくわからない」
といった人向けに蒸溜の基礎から、わかりやすく解説しますので、気になった方はぜひ読んでいって下さい。
余談ですが、「蒸溜」と「蒸留」の二種類の表記がありますが、意味は同じで「蒸溜」が元の表記で、それが簡略化されて「蒸留」とも表記するようになったらしいです。
この記事では、個人的な好みで「蒸溜」と表記しています。
そもそも蒸溜とは
出典: フリー百科事典『ウィキペディア(Wikipedia)』 では
『蒸留(じょうりゅう、蒸餾、Distillation)とは、混合物を一度蒸発させ、後で再び凝縮させることで、沸点の異なる成分を分離・濃縮する操作をいう。通常、目的成分が常温で液体であるか、融点が高々100℃程度の固体の場合に用いられる。共沸しない混合物であれば、蒸留によりほぼ完全に単離・精製することが可能であり、この操作を特に分留という。』
と説明されています。
なんだか難しい言葉がたくさん出てきました(笑)
簡単な言葉に言い換えると、
「沸騰する温度が違う液体を一緒に温めると、沸騰しやすい成分のほうが気体になりやすいので、この気体を回収し冷まして液体に戻すことで成分の濃度を高めること」
ざっくりいうとこのような意味です。
正確に言うと「温める」必要はなく、室温でほったらかして蒸発させたものを回収して、液体に戻しても蒸溜と言います。
ですが、ウイスキーメディアなのであえて「温める」を入れました。(笑)
この段階ではまだ、なぜエタノール100%が不可能なのかわかりませんね。
それを説明するためにも蒸溜の原理についてみていきましょう。
蒸溜の原理
2つのコップがあります。片方には水を、もう片方には油を同じ量入れてあります。
このまま放置し続けるとどうなるでしょうか?
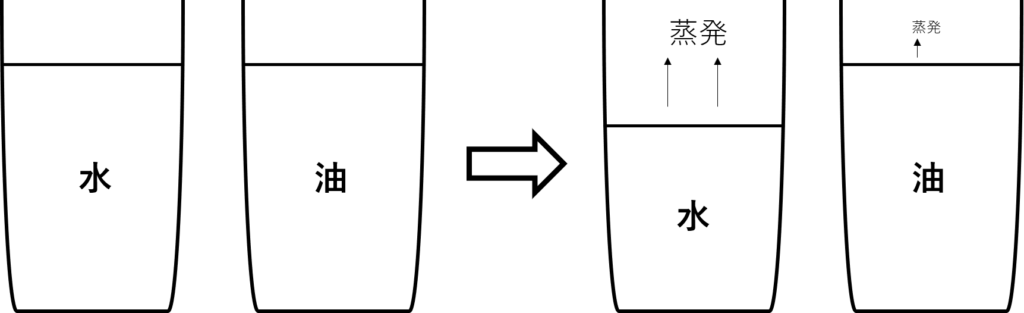
答えは、水の方だけどんどん量が減っていき、油の方は量がほとんど変わりません。
これは、水の方が油より蒸発しやすいからです。
水は100℃で沸騰して気体になりますが、油は200℃、300℃でも液体のままです。
つまり水の方が気体になりやすい性質があるのです。
次に水とエタノールを比べたときはどうでしょう。
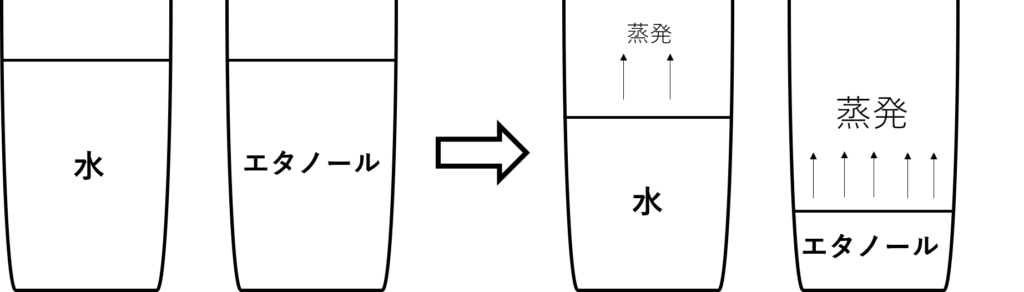
今度は水よりもエタノールの方がより早く量が減っていきます。
これは、エタノールの方が水より蒸発しやすいからです。
エタノールの沸点(沸騰する温度)は78.3℃ですので、水よりも気体になりやすい性質があります。
次にこのコップにフタをしたらどうなるでしょうか?
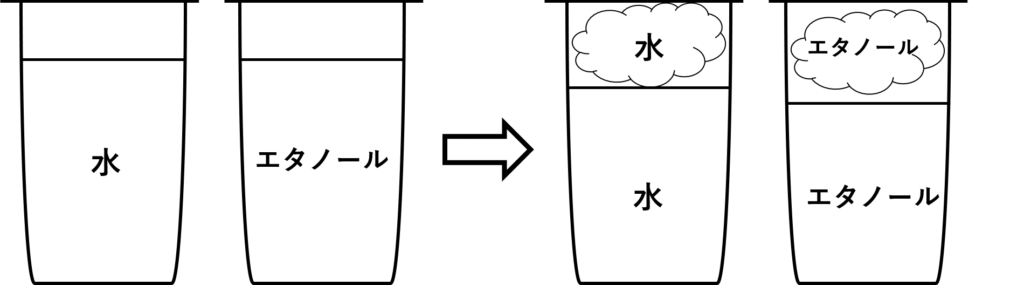
今度は水とエタノールどちらも、少し量が減って以降変わらなくなりました。
これは、密閉された空間に水とエタノールどちらも蒸発できるだけしてしまった状態(飽和状態)になったからです。
キャップを閉めたペットボトルの中身や、しっかりフタをして保管しているウイスキーは、ほとんど量が変わらないけど、グラスに入れてうっかり寝てしまい、翌日見たら全部蒸発していたという経験はないでしょうか?
それは、まさにこの話です。なので、できるだけウイスキーを蒸発させたくなければできるだけ密閉し飽和状態を保った方がいいのです。パラフィルムでキャップの周りを密閉するなどは理にかなっているのでおすすめです。
話を戻します。
今度は水とエタノールを同じ量混ぜて大きなコップに入れた場合はどうなるでしょうか?

この場合も先ほどと同様に水とエタノールが蒸発して、飽和状態になったところで液量の低下が止まります。
しかし少し違うのは、エタノールの方がより蒸発しやすいので気体の成分はエタノールの割合が水よりも多くなります。
逆に、液体側ではエタノールが多く抜けたため、水の割合が多くなります。
これが「蒸溜」の原理です。気体になりやすい性質の違いを利用すると、成分の濃度を上げることができるのです。
さて、蒸溜の原理がわかったところで次はエタノールの濃度をもっと上げていきましょう!
先ほどの気体の部分だけを新しいコップに回収して液化させるとどうなるでしょうか?

気体ではエタノールの成分が多かったので、これを液化させると当然アルコールの割合が最初より多い液体になります。
このコップを先ほどと同様に放置し続けると、また飽和状態まで蒸発したあと、液量は変わらなくなります。
このとき、気体成分ではアルコールの割合(濃度)がさらに増えます。
この気体を回収して、蒸発させて、回収して、蒸発させて・・・・・・
と繰り返していけばどんどんエタノール濃度は上がっていき、最終的にはほぼ100%のエタノールが手に入りそうですが、実は約96%までしか濃度は上がりません。それ以降は何回、何万回蒸溜しても96%のままなんです。
なぜ、エタノール100%は不可能なのか詳しく説明します。
なぜエタノール100%は不可能なのか
なぜ、エタノール100%は不可能なのかを理解するためには「気液平衡」を理解しなくてはいけません。
気液平衡とは、液体が気体になる「蒸発」と気体が液体になる「凝縮」の速さが等しくなって、見かけ上変化がない状態(平衡状態)のことを言います。
少し難しく感じたかもしれませんが、もう既に気液平衡は出てきています!
先ほどのコップの例、気体の量が飽和してそれ以上変わらない状態。あれが気液平衡の状態です。
見た目ではわかりませんが、気体は常に液体になり、それと同じ量だけ液体は気体になり続けていたんです。
気液平衡のグラフの読み方
気液平衡は理論的または実験的に測定してグラフを得ることができます。
まずはそのグラフの読み方を見ていきましょう。
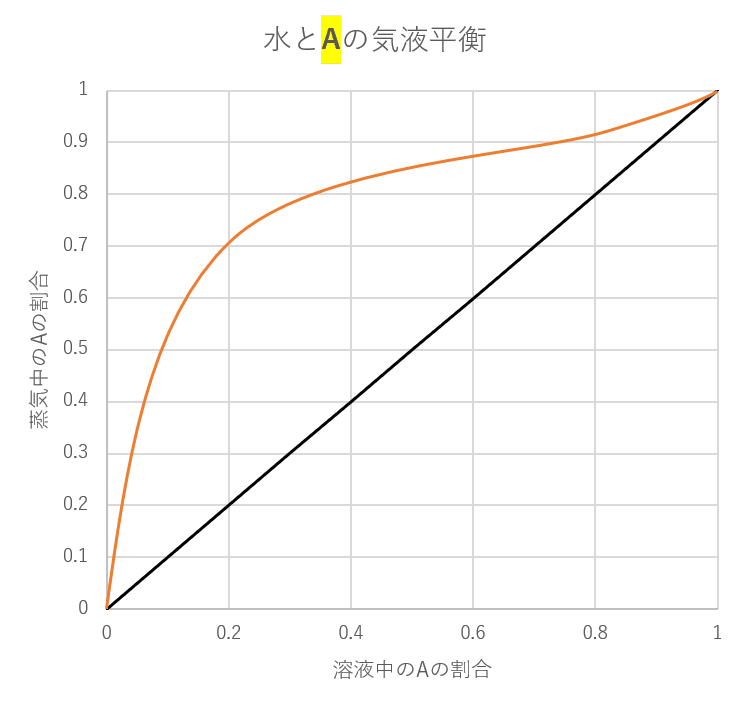
こちらに、水と物質Aを混ぜたときの気液平衡のグラフを示します。
オレンジ色の線が気液平衡時の値で、黒の直線は補助線です。
このグラフを使えば、
「液体の水とAの割合が1:1のとき気体の方では水とAの割合は水が約15%,物質Aが85%である」とわかります。
使い方を説明します
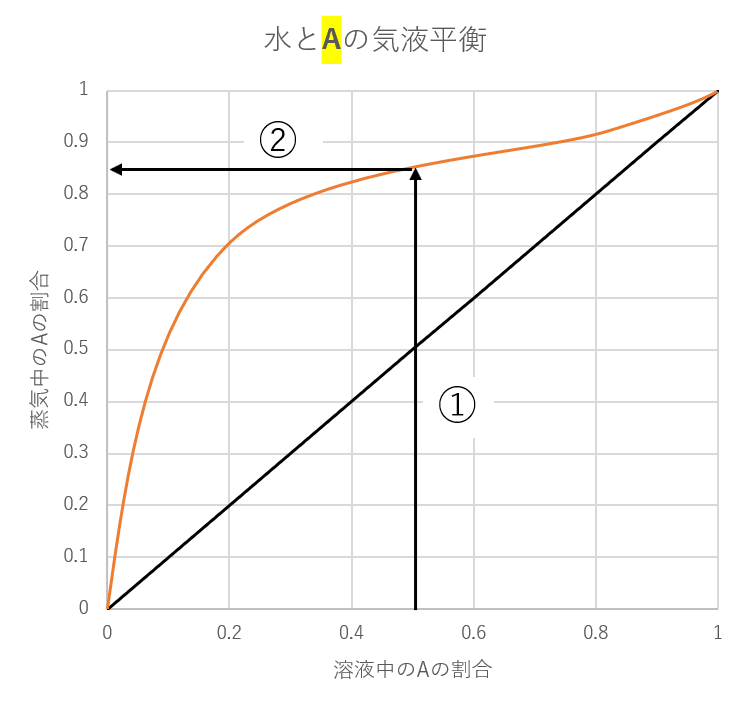
横軸は液体の中にAがどれくらいあるかの割合を縦軸は気体の中にAがどれくら存在しているかの割合を表しています。
Aがまったくないときは0で、
Aが100%のときは1です。
液体の水とAの割合が1:1のとき、Aは全体の50%の割合で存在しているので、横軸の値は0.5です。
①0.5からまっすぐ上に線を引いていき、気液平衡の線と重なるまで引く。
②線が重なった点から真横に線を引く。
このときの縦軸の値が気体中のAの割合を示してくれます。ここでは0.85ですので約85%がAであることがわかります。
ここでのポイントは気液平衡の線が補助線よりも上にある時は、気体の濃度が上がるということです。補助線は横軸0.5のとき、縦軸も0.5になり濃度が変わらないのがわかると思います。
また、このグラフは補助線を使うと他にもこんな使い方ができます。
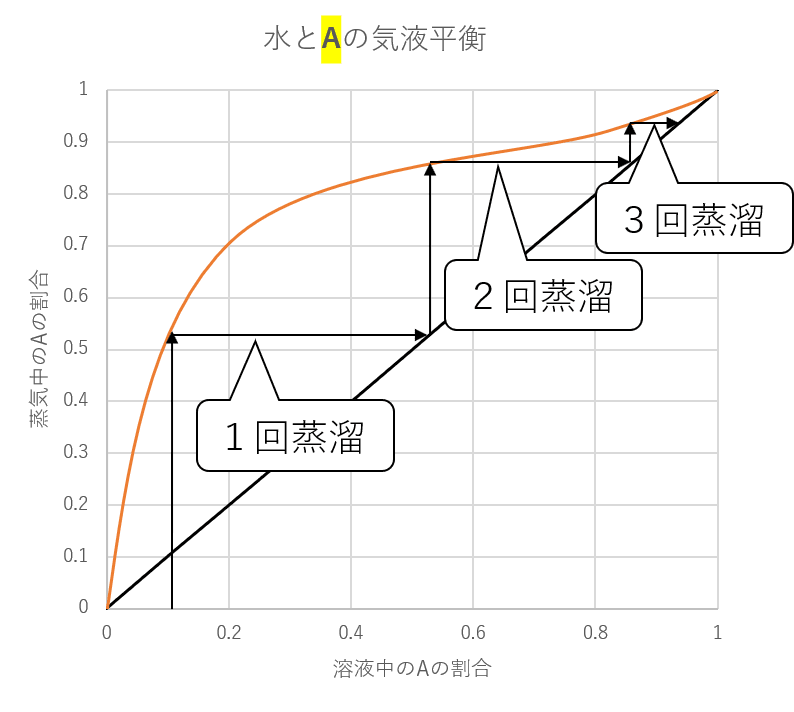
最初にAの濃度が0.1(10%)の溶液があったとき、3回蒸溜すると約94%にまで濃度が上がることがすぐにわかります。
横軸0.1のところからまっすぐ上に線を引き、気液平衡の線に重なったら、今度は右に引くことで、補助線と重なるところがこの気体を集めたときの横軸の位置になり、また上に引いていく、というのを繰り返せば何回蒸溜したら、どれくらいの濃度になるかがわかります。
水と物質Aの場合、気液平衡の線が常に補助線よりも上にあるため、蒸溜を繰り返せばほぼ100%の物質Aを手に入れることができるのがわかります。
水とエタノールの気液平衡
それでは、気液平衡のグラフの読み方がわかったところで、本題の水とエタノールの気液平衡のグラフを見ていきましょう!
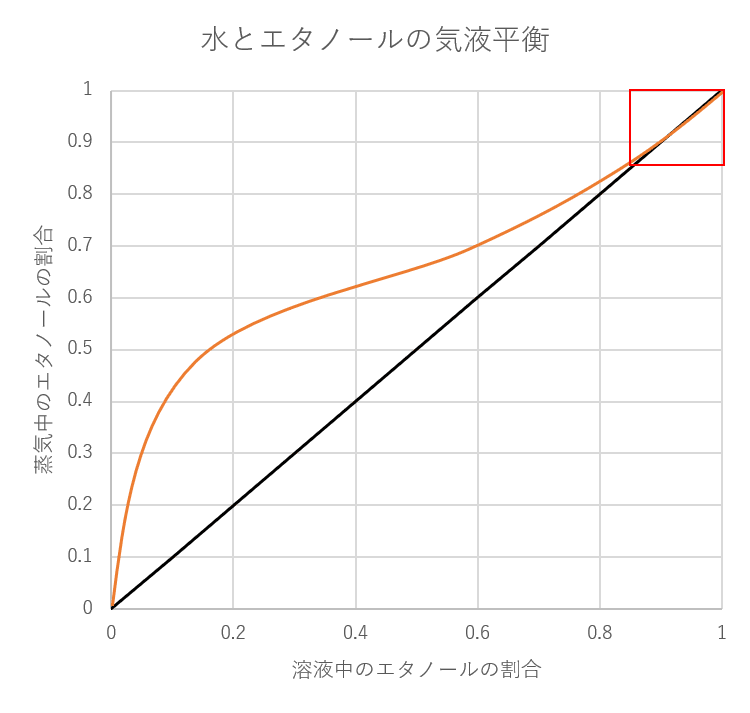
エタノールの気液平衡のグラフは先ほどまでのグラフとほとんど変わらないように見えます。
しかし、右上の赤い四角で囲った部分を拡大すると次のようになっています。
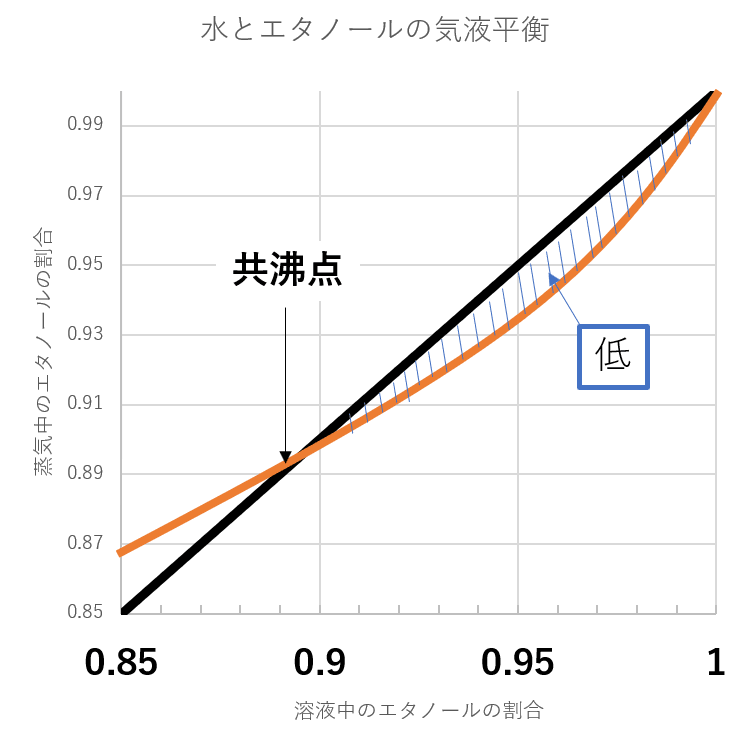
液体でのエタノールの割合が0.89よりも多くなると気液平衡の線が補助線よりも下になっています。
このような、気液平衡線と補助線が重なる点を共沸点と呼びます。
その名の通り、水とエタノールが共に沸騰する点、つまり水とエタノールの沸点が同じになるということです。
気液平衡線が補助線よりも下にあるということは、その状態で蒸溜するとエタノールの濃度が下がることを意味します。
もし仮にエタノール100%の液があったとしても空気中の水分がすぐに入ってきて共沸点である0.89になって落ち着きます。
実は、横軸はモル分率という日常生活ではあまり使われない表記です。
水に対するエタノールのモル分率0.89を体積での割合に計算すると約96%となります。
なので、例えばアルコール度数8%の麦汁を何万回蒸溜しても、アルコール度数は96%までしか上がらないのです。
なぜ、エタノールと水の沸点が同じになるのか。
これは水とエタノールの相互作用(水素結合など)が働くためです。
水は0℃で凍るが、アルコール度数40%のウイスキーは冷凍庫に入れても凍らないという話は聞いたことがありませんか?これは水とエタノールが混ざると水の凍る温度が下がるためです。
このように2つの違う物質が混ざると凍る温度や沸騰する温度が変化します。
その変化の仕方は物質同士で千変万化、ほとんど変わらないもの同士もあれば大きく変わるものもあります。
そして、水とエタノールの場合は沸点がちょうど同じになるのが度数96%だったというわけです。
おわりに
以上、なぜエタノール100%が不可能なのか、について解説しました。
少しでも楽しんでいただけたでしょうか?
何か気になったこと、質問などありましたらコメントしてください!
今回の記事に関係なく、「これについて解説してほしい!」なども大歓迎です!
また、お会いしましょう。
乾杯!






コメント